液-液相分離-アルツハイマー病、パーキンソン病、白内障で重要な役割を発見 インド
インド科学技術庁 (Department of Science and Technology: DST)傘下の独立研究機関である国立S. N. ボース基礎科学センター(S. N. Bose National Center for Basic Sciences)は、「液-液相分離」(Liquid-Liquid Phase Separation: LLPS)によってタンパク質の水和がどのように変化するかを調査し、液体中の水がLLPSにおいて、神経変性疾患の鍵を握る重要な役割があることを発見した。インド科学技術省(MoST)が9月1日付けで発表した。
この研究で、医薬品やスクロースなどの他の活性物質の媒体または媒体として機能する一部の賦形剤(ふけいざい)、または不活性物質が LLPS を安定化できる一方で、一部はそれを阻害できることを明らかにした。したがって、これらの疾患の凝集プロセスは、これらの賦形剤を使用して水ネットワークのダイナミクスを変更することで調整できる。

異なる条件下での Lys の顕微鏡画像:
(a) 相分離なし、(b) Lys のみ (600 μM)、(c) Lys-100 mM Argsolution、(d) Lys-10 mM スクロース溶液、(e) Lys-50 μM BSA 溶液、および (f) Lys-100 μM Ubi 溶液。すべての測定は、50°Cで6時間のインキュベーション後に実行された。 Lysの濃度は00μMに固定し、溶液のpHは12.6であった
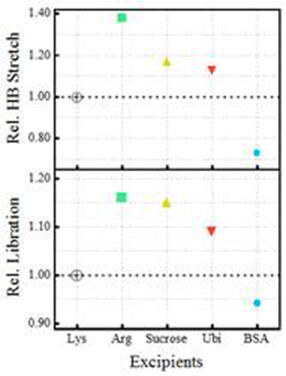
賦形剤存在下でのリゾチームのLLPS 形成中の全体的な水和の相対的変化 (Lys中のLLPS をHB 伸縮モードと解放モードの両方の1単位とする)
(いずれもPIBリリースより)
タンパク質の水和ダイナミクスは、さまざまな神経変性疾患への準備段階で、いくつかのタンパク質の凝集において極めて重要な役割を果たす。したがって、凝集プロセスは、水ネットワークのダイナミクスの変化を検出することによって早期に発見され、また、同プロセスは、薬物または他の活性物質の媒体として機能する不活性物質を使用して調整できる可能性があることが分かった。
衰弱させる神経変性疾患を分子レベルで理解することは、それらの治療法や解決策を見つけるために不可欠である。「液-液相分離」(LLPS)と呼ばれる現象は、例えばP体のような細胞の細胞質における膜のないコンパートメントである核小体は、細胞オルガネラの形成を促進する。自己凝集システムである LLPS は、安定したタンパク質凝集体の形成中の中間ステップである。多価タンパク質が相互作用すると、タンパク質濃度の増加に伴い、小さな複合体から大きなポリマー集合体へと急速に変化する。この密な相は、多くの場合、周囲の媒体よりも高いタンパク質密度と弱い分子運動を示す液滴に似ている。
液-液相移動によって開始されるこのプロセスは、人間の病気、特にアルツハイマー病、パーキンソン病、白内障などの加齢に伴う神経変性疾患の誘発に重要な役割を果たす。したがって、相分離のプロセスを分子レベルで理解することは、分子生物学の研究者コミュニティでは新たな研究分野となっている。
The Journal of Physical Chemistryで発表された論文において、ラジブ・クマール・ミトラ(Rajib Kumar Mitra)教授をはじめとする研究者は、アルギニン、グルコース、ユビキチン、ウシ血清アルブミン(BSA)の4つの賦形剤を調査した。その結果、スクロースなどの一部の賦形剤は LLPS プロセスを安定化するが、ウシ血清アルブミンはこのプロセスを阻害することが分かった。この研究では、タンパク質と賦形剤の水和の両方が LLPS プロセスの調節に重要であることが確認され、水和の変化がLLPSの発症を早期かつ容易に検出するための潜在的なマーカーとして機能する可能性があることが判明した。
サイエンスポータルアジアパシフィック編集部






