概日リズムを制御する主時計と従時計の分子機構の違いを解明 韓国KAIST
韓国科学技術院(KAIST)は2月23日、同院の研究チームが、生物の概日リズム(circadian rhythm)を強力かつ柔軟に制御する分子的な機構を、数理モデルを用いて解明したと発表した。研究成果は米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America:PNAS)に発表された。
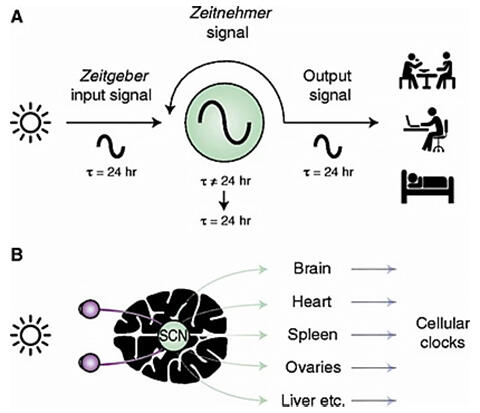
概日時計(circadian clock)を制御する分子機構は、2017年のノーベル生理学・医学賞を受賞した研究によって発見された。概日時計は環境からの信号を受け取る「主(master)」のペースメーカー(pacemaker)と、ペースメーカーの指示を受けて睡眠、摂食、代謝等の出力を制御する「従(slave)」の振動体(oscillator)から成る階層的ネットワークに基づいて動作していることが知られている。
(提供:KAIST)
KAISTの数理科学科のキム・ジェキョン(Kim Jae Kyoung)教授が率いる研究チームは、数理的手法とミバエ(fruit fly)を用いた実験的手法とを組み合わせ、これらの主時計と従時計がそれぞれ異なる分子機構を通じて動作していることを発見した。
研究チームは主時計と従時計の分子時計機構を説明する数理モデルを開発し、コンピューターシミュレーションを用いて、主時計と従時計のニューロンの間に存在する可能性のある全ての分子的な差異を体系的に調べた。このモデルにより、主時計では概日リズムに関連するPERタンパク質が従時計よりも効率的に生産されると予測し、動物を用いた実験によってこれを裏付けた。
PERの高速な合成によって作られる振幅(amplitude)が高い強力なリズムは、主時計が従時計に明確な信号を届けるために不可欠となる。同時に主時計ニューロンのこの性質は、標準的な明暗サイクルが壊れた時にPERの量を大幅に減らし、環境変化に柔軟に適応するうえで役立つという。
この研究は、睡眠障害等、概日リズムに関連するさまざまな障害の治療に役立つと期待されている。
サイエンスポータルアジアパシフィック編集部





