ソマトスタチンの役割発見―神経伝達がアルツハイマー病の毒性を抑える鍵に 韓国
世界には約5,000 万人の認知症患者がおり、アルツハイマー病は最も一般的な神経変性疾患である。その主な症状は、話す能力や記憶する能力など、一般的な認知能力の障害である。高齢化が進み、寿命は延び続けていることから、多くの人々は治療法発見の重要性を理解している。しかし、この不快な病気は、その原因でさえ、まだ明確には分かっていない。
ミヒー・リム (Mi Hee Lim) 教授が率いる韓国科学技術院 (KAIST) 化学科の研究チームは、今まで知られていなかったソマトスタチンの役割を発見した。ソマトスタチンはタンパク質から成り立つ神経伝達物質 であり、アルツハイマー病を発症させる病原メカニズムで引き起こされる毒性を軽減するというのである。この研究は、Nature Chemistry 誌の7月号に、「銅とアミロイド β の存在下で天然神経ペプチド・ソマトスタチンの構造と機能の変化 (Conformational and functional changes of the native neuropeptide somatostatin occur in the presence of copper and amyloid-β)」というタイトルで発表された。
アミロイド仮説によると、アミロイドβタンパク質が異常な沈着を示すと、神経細胞の死を引き起こす。線維症により老化したプラークの大部分でアミロイドβタンパク質のかたまりが見られるが、最近の研究では、アルツハイマー病患者のプラークに高濃度の遷移金属が見つかった。
これは、タンパク質の線維化を促進する金属イオンとアミロイドβタンパク質の間に密接な相互作用があることを示す。特にレドックス活性遷移金属である銅は、大量の酸素を生成し、細胞小器官に重度の酸化ストレスを引き起こすことがある。アミロイドβタンパク質と遷移金属は、シナプスで神経伝達物質と密接に相互作用することがあるが、そのような異常な状態が神経伝達物質の構造と機能に与える直接的な影響はまだ分かっていない。
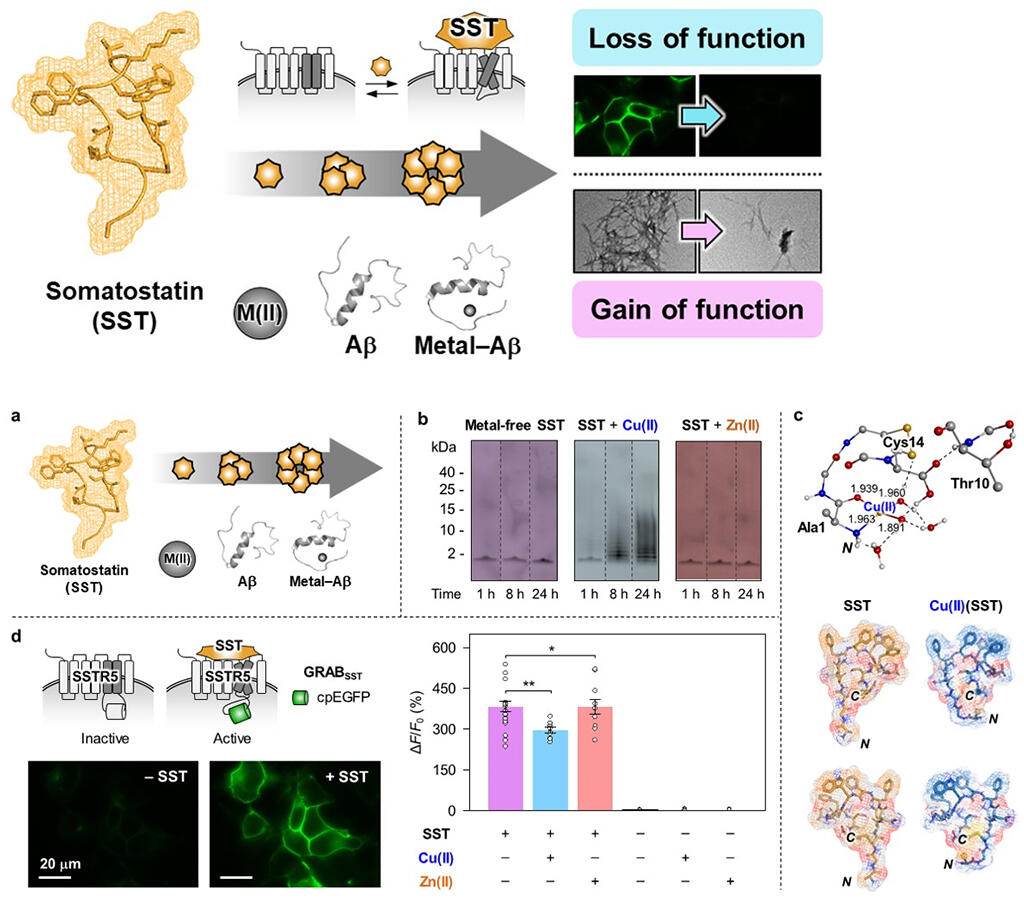
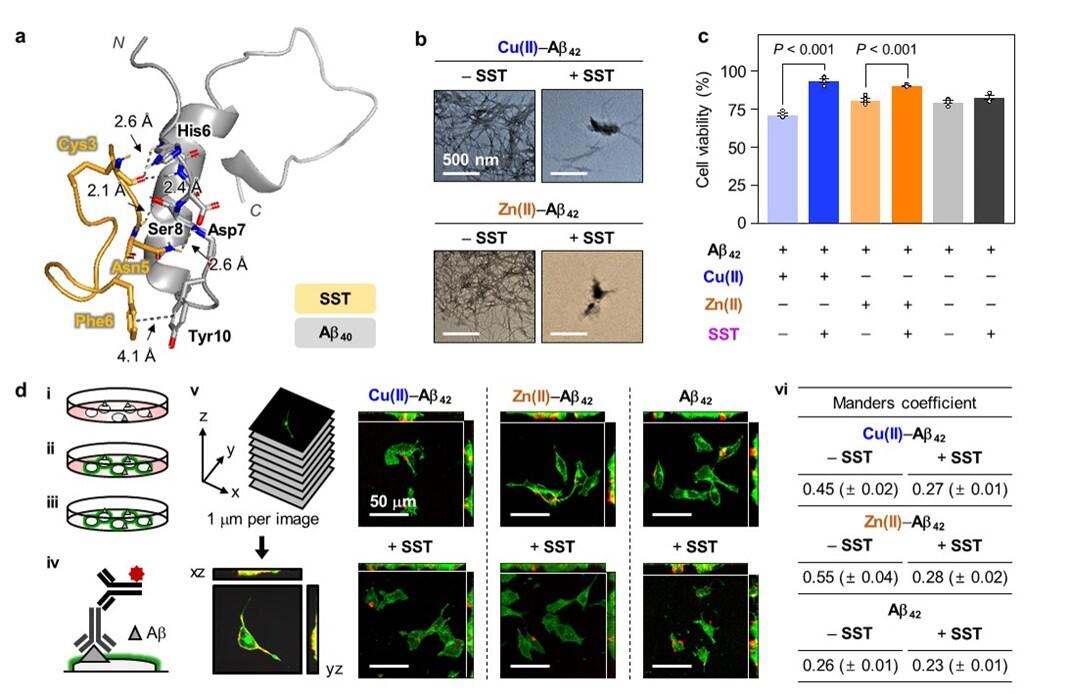
リム教授の研究チームは、タンパク質の神経伝達物質であるソマトスタチンが銅やアミロイドβタンパク質、金属-アミロイドβ複合体に触れると自己凝集し、神経信号を伝達するという本来の機能を果たさなくなるが、金属-アミロイドβ複合体の毒性や凝集を抑制する働きが始まることを発見した。
(提供:いずれもKAIST)
KAIST化学科のジェオン・ハン (Jiyeon Han) 博士らによるこの研究は、銅とソマトスタチンの間の配位構造を分子レベルで明らかにし、それにより凝集メカニズムが示され、ソマトスタチンが金属の有無に応じてアミロイドβタンパク質の凝集経路に与える影響が理解された。チームはソマトスタチンの受容体結合、細胞膜との相互作用、細胞毒性への影響も初めて確認し、国際的な注目を集めた。
ミヒー・リム教授は、「この研究は、アルツハイマー病の病因における神経伝達物質の新しい役割を発見したことに大きな意味があります。この研究は、加齢に伴う神経変性疾患の発症ネットワークの解明や、将来のバイオマーカーや医薬品の開発に貢献することが期待されます」と話している。






