【AsianScientist】視力回復へ幹細胞療法を開発―シンガポールとスウェーデンの研究チーム
シンガポールとスウェーデンの研究チームは、失われた光受容体を補うために、前臨床モデルで実行可能な幹細胞治療手法を開発した。(2023年6月23日公開)
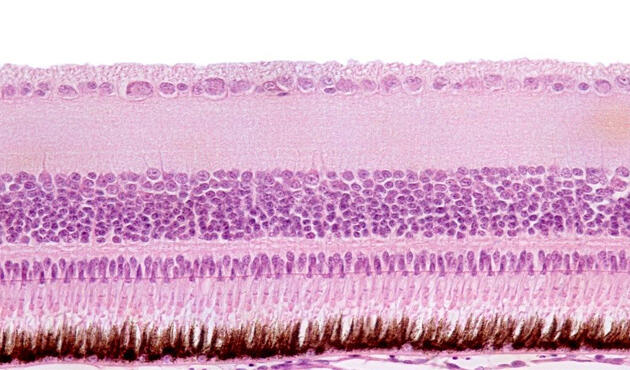
あなたが本記事を読む間にも、網膜にある光を感知する特殊なニューロンである光受容体は、光を電気信号と化学信号に変換し続けている。これにより、脳は画像を組み立て、あなたはそれを認識する。加齢黄斑変性症 (AMD) や稀な遺伝性疾患である網膜色素変性症などといった網膜疾患を患うと光受容体は劣化し、世界でも視力低下と最終的な失明の主な原因の1つとなっている。現在のところ、エッセンシャル細胞の再生に役立つ治療法はまだ存在しない。研究者たちは、これらの衰弱性疾患に対するさまざまな治療法を開発しようとしてきたが、その再現性と実現可能性に限界があるため、臨床応用は難しかった。
最近、シンガポールとスウェーデンの研究チームは、網膜変性疾患患者の失われた光受容体を置換することで視力を回復させる可能性を持つ、有望な幹細胞療法を発表した。この研究成果はMolecular Therapy誌に掲載された。
デューク大学-シンガポール国立大学医学部(Duke-NUS Medical School) 、シンガポール眼科研究所、およびスウェーデンのカロリンスカ研究所の研究者たちは、力を合わせてこの問題を克服しようとしている。チームは協力して幹細胞を光受容体の前駆細胞に変換する手法を考案した。これは再現性が高く、損傷した網膜を有する動物に移植したところ、視力が部分的に回復することが判明した。
チームは、変異(アイソフォームと呼ばれる)したラミニンの存在下でヒト胚性幹細胞を増殖させた。ラミニンは通常網膜に豊富に含まれるタンパク質である。32日間で、幹細胞は光受容体前駆細胞に分化し、前駆細胞に特徴的なマーカーを発現し始めた。
Duke-NUS視覚研究センター(Duke-NUS' Centre for Vision Research)の助教授で、研究論文の筆頭著者であるテイ・ヒウィー・グーン (Tay Hwee Goon) 氏は、Asian Scientist Magazine誌に対し、「私たちは、ラミニン・アイソフォームを使用してヒト網膜マトリックスを再現すれば、ヒト胚性幹細胞の光受容体への分化に役立ち、促進することができると仮説を立てています」と述べた。
これらの幹細胞由来の光受容体をげっ歯類の損傷した網膜に移植してから 4週間後、細胞は成熟した光受容体と同様のマーカーを発現し始めた。水迷路水泳試験を使用した視覚的行動評価では、視力の大幅な改善が示された。研究チームは、損傷した網膜の相当な回復を証明するために、光刺激に反応する網膜の電気活動を測定する網膜電図検査も実施した。さらに、20週間という長期間にわたって行われた研究から、移植された細胞が近くの宿主細胞と結合し、移植後、実際に数週間生存することが分かった。
このように有望な結果が出たため、テイ助教授とチームは、この治療法が臨床使用に承認される可能性を高めるために、細胞培養の従来の手法を選択しないことを決めた。一般的な細胞分化培地はウシや子牛の血清を含むため、バッチごとにばらつきが生じる可能性がある。だが、チームは、化学的に定義され動物由来原料を含まない成分で作られた独自の増殖培地を使用した。
「一貫した細胞製造を行えば、細胞製品の管理は高度なものになります。試験結果の一貫性はさらに高まるため、非常に注目されています。このことは、規制当局の臨床承認審査にプラスの影響を与える可能性があります」とテイ助教授は述べる。
これらの発見は、網膜の損傷を回復し、光受容体の喪失による視力低下を治療する、実現可能性のある再生療法への第一歩となる。テイ助教授らが開発したこの治療法のプロトコルは、スウェーデンのバイオベンチャー企業であるAlder Therapeutics社にライセンス付与された。テイ助教授によると、同社は臨床グレードの幹細胞由来視細胞前駆体の製造の品質管理に注力するという。
テイ助教授は「これらの細胞はその後、ヒトでの臨床試験に進む前に、5年間にわたり前臨床モデルで安全性と有効性について広範囲にわたり試験されることになります。 これらの段階は、臨床試験が成功した場合、商業的に使用される最終細胞製品を製造し、最適化するために重要です」と述べた。






